Teori Asam-Basa Arrhenius
Asam-Basa dalam Kehidupan Sehari-hari
Sejak berabad-abad yang lalu, para pakar mendefinisikan asam dan basa berdasarkan sifat larutannya. Larutan asam mempunyai rasa masam dan bersifat korosif (merusak logam, marmer, dan berbagai bahan lain), sedangkan larutan basa berasa agak pahit dan bersifat kaustik (licin, seperti bersabun). Mengapa cuka, belimbing, dan jeruk sama-sama mempunyai rasa masam??
Svante Ausgust Arrhenius,ahli kimia berkebangsaan Swedia, tercatat sebagai pemenang hadiah nobel kimia pada tahun 1903.
Untuk menjelaskan penyebab sifat asam dan basa, sejarah perkembangan ilmu kimia mencatat berbagai teori. Pada tahun 1777, Antoine Laurent Lavoisier (1743-1794) menge-mukakan bahwa asam mengandung unsur oksigen. Unsur itu yang dianggap bertanggung jawab atas sifat-sifat asam. Namun, pada tahun 1810, Sir Humphry Davy (1778-1829) menemukan bahwa asam hidrogen klorida tidak mengandung unsur oksigen. Davy kemudian menyimpulkan bahwa unsur hidrogenlah, dan bukan unsur oksigen yang merupakan unsur dasar dari setiap asam. Kamudian pada tahun 1814, Joseph Louis Gay-Lussac (1778-1850) menyimpulkan bahwa asam adalah zat yang dapat menetralkan alkali dan kedua golongan senyawa itu hanya dapat didefinisikan dalam kaitan satu dengan yang lain.
Konsep yang cukup memuaskan tentang asam dan basa, dan yang tetap diterima hingga sekarang, dikemukakan oleh Svante August Arrhenius (1859-1927) pada tahun 1884.
a. Asam
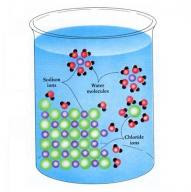
Garam NaCl dalam air
Svante August Arrhenius (19 Februari 1859 – 2 Oktober 1927) seorang ilmuwan Swedia mendefinisikan teori asam-basa sebagai berikut:
Asam adalah suatu spesies yang akan meningkatkan konsentrasi ion H+ di dalam air dan basa adalah suatu spesies yang akan meningkatkan konsentrasi ion OH- di dalam air.
Atau dengan pernyataan lain
Asam adalah suatu spesies yang apabila dilarutkan dalam air akan menghasilkan ion H+ dan basa adalah suatu spesies yang bila dilarutkan dalam air akan menghasilkan ion OH-.
Sebagai contoh gas HCl ketika dilarutkan dalam air akan menghasilkan ion H+ dan Cl- sehingga menurut konsep ini HCl dalam larutan air adalah asam.
HCl(g) → H+(aq) + Cl-(aq)
Contoh asam yang lain adalah HF, HBr, HNO3, H2SO4, H3PO4, CH3COOH, H2C2O4, dan sebagainya. Sedangkan KOH bila dilarutkan dalam air akan menghasilkan ion K+ dan OH- oleh sebab itu KOH menurut teori Arrhenius adalah basa.
KOH(s) → K+(aq) + OH-(aq)
Contoh yang lain adalah NaOH, Ca(OH)2, NH4OH, Ba(OH)2 dan lainnya.
Teori asam basa menurut Arrhenius adalah teori yang amat sempit mengingat teori ini hanya terbatas pada spesies yang memiliki H+ atau OH- dan spesies tersebut ada dalam pelarut air artinya apabila spesies tersebut tidak memiliki H+ atau OH- dan reaksinya dijalankan dengan pelarut non-air maka teori ini tidak berlaku.
Sebagai contoh gas ammonia (NH3) dapat bereaksi dengan gas HCl membentuk ammonium klorida padat dengan reaksi sebagai berikut:
NH3(g) + HCl(g) → NH4Cl(s)
Reaksi diatas adalah salah satu contoh reaksi asam basa yang tidak bisa dijelaskan dengan teori Arrhenius disebabkan reaksi diatas tidak melibatkan adanya H+ dan OH-. Apabila reaksi diatas dilakukan dalam medium air maka yang terlibah adalah larutan NH4OH dan larutan HCl dengan reaksi berikut;
NH4OH(aq) + HCl(aq) → NH4Cl(aq) + H2O(l)
Jumlah ion H+ yang dapat dihasilkan oleh satu molekul asam disebut valensi asam, sedangkan ion negatif yang terbentuk dari asam setelah melepas ion H+ disebut ion sisa asam. Nama asam sama dengan ion sisa asam dengan didahului kata asam. Berbagai contoh asam dan reaksi ionisasinya diberikan pada tabel berikut.
| Rumus Asam | Nama Asam | Reaksi Ionisasi | Valensi Asam | Sisa Asam |
| HCl | Asam klorida | HCl → H+ + Cl- | 1 | Cl- |
| HCN | Asam sianida | HCN → H+ + CN- | 1 | CN- |
| H2S | Asam sulfida | H2S → 2H+ + S2- | 2 | S2- |
| H2SO4 | Asam sulfat | H2SO4 → 2H+ + SO42- | 2 | SO42- |
| H3PO3 | Asam fosfit | H3PO3 → 2H+ + HPO32- | 2 | HPO32- |
| HCOOH | Asam format | HCl → H+ + HCOO- | 1 | HCOO- |
| CH3COOH | Asam asetat | HCl → H+ + CH3COO- | 1 | CH3COO- |
b. Basa
Asam-Basa Arrhenius
Menurut Arrhenius, basa adalah senyawa yang dalam air dapat menghasilkan ion hidroksida (OH-). Jadi, pembawa sifat basaadalah ion OH-. Basa Arrhenius merupakan hidroksida logam, dapat dirumuskan sebagai M(OH)x, dan dalam air mengion sebagai berikut.
M(OH)x (aq) → Mx+ (aq) + xOH- (aq)
Jumlah ion OH- yang dapat dilepaskan oleh satu molekul basa disebut valensi basa. Beberapa contoh basa Arrhenius diberikan pada table berikut.
| Rumus Basa | Nama Basa | Reaksi Ionisasi | Valensi |
| NaOH Ca(OH)2 Ba(OH)2 Al(OH)3 | Natrium hidroksida Kalsium hidroksida Barium hidroksida Aluminium hidroksida | NaOH → Na+ + OH- Ca(OH)2 → Ca2+ + 2OH- Ba(OH)2 → Ba2+ + 2OH- Al(OH)3 → Al3+ + 3OH- | 1 2 2 3 |
Meskipun tidak mempunyai gugus hidroksida, larutan ammonia (NH3) ternyata bersifat basa. Hal itu terjadi karena NH3 bereaksi dengan air (mengalami hidrolisis) membentuk ion OH- sebagai berikut.
NH3 (aq) + H2O (l) ↔NH4+ (aq) + OH- (aq)
Untuk menunjukkan sifat basanya, larutan NH3 sering ditulis sebagai NH4OH. Hal itu tidaklah benar karena NH4OH tidak ditemukan, yang ada hanya NH3, ion NH4+, serta ion OH-.



Tidak ada komentar:
Posting Komentar